Il ne suffit pas d’acheter un équipement pour pouvoir l’utiliser dans un environnement pharmaceutique ; la qualification et la validation seront toujours obligatoires. Leur principal objectif n’est pas de vous empêcher d’utiliser l’équipement ni d’en augmenter les coûts, mais de vous aider à garantir une qualité constante des produits finaux.
Chez Sensum, nous interagissons avec de nombreuses équipes d’assurance qualité pharmaceutique sur le thème de la qualification et de la validation, tout en développant et en fournissant des solutions pour l’inspection visuelle automatique des produits finis, nécessitant un contrôle plus étroit par l’assurance qualité que par les systèmes de contrôle qualité. Depuis plus de 15 ans, nous avons expérimenté différents scénarios de qualification, ce qui nous a permis d’identifier plusieurs bonnes pratiques. Dans les paragraphes suivants, vous trouverez un aperçu pratique du processus de qualification et plusieurs conseils utiles qui pourraient vous aider dans tout projet de qualification.
Tout d’abord : qu’est-ce que la validation et qu’est-ce que la qualification ?
La validation est un concept plus large que la qualification. Elle est liée à des processus tels que le processus de fabrication. Cela peut être simplement expliqué par une approche systématique qui vérifie et aide les processus à obtenir des résultats attendus et cohérents. La validation n’implique pas seulement l’équipement, mais également plusieurs systèmes supplémentaires, logiciels et personnes inclus dans le processus.
La validation se décompose en plusieurs activités, dont la qualification, qui est liée à l’introduction de systèmes dans le processus. Le travail de qualification consiste à s’assurer qu’un système particulier répond aux exigences réglementaires, aux normes industrielles et aux performances attendues
Le (tristement) célèbre modèle en V
L’étendue de la qualification dépend de la complexité de l’équipement. Par exemple, la qualification d’un conteneur en vrac intermédiaire devrait nécessiter moins d’efforts qu’un système d’inspection visuelle. Nous examinerons la qualification d’un système informatisé configuré, qui couvre toutes les étapes typiques de la qualification. La procédure de qualification pour l’exemple est présentée dans le modèle en V ci-dessous avec deux phases, la spécification et la vérification.
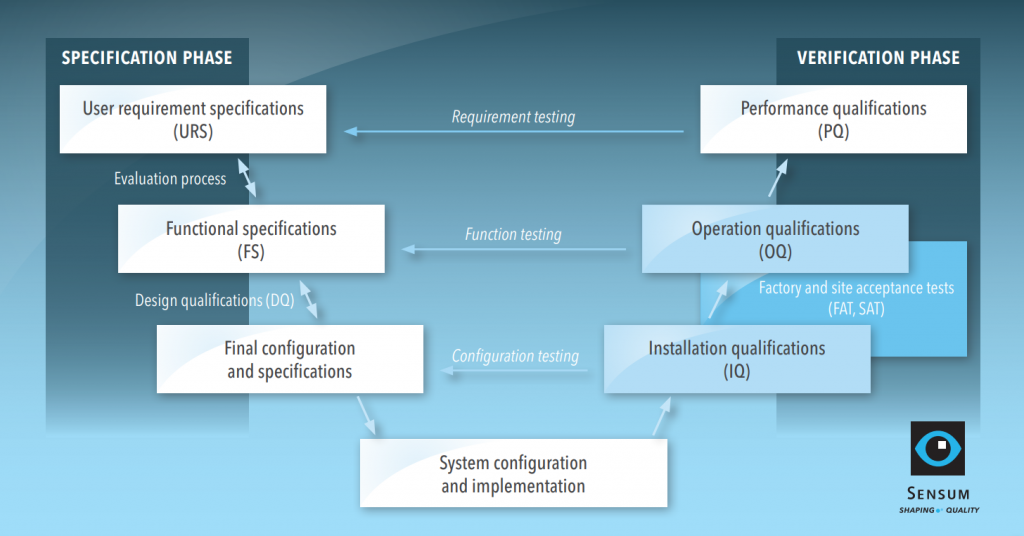
Phase de spécification : des SBU à la QC
Les Spécifications des besoins utilisateur (SBU) sont préparées par l’utilisateur final qui répertorie ses attentes et exigences pour son processus. Les SBU constituent un document de base qui rationalise l’ensemble du processus de qualification.
Chez Sensum, en tant que fournisseur, nous consultons de nombreuses SBU. La plupart des documents SBU comportent de nombreuses exigences sur plus de 20 pages, mais les exigences réelles pertinentes pour le projet spécifique sont brièvement décrites. Cela se produit parce que les SBU sont préparées à partir d’un modèle ou à partir des SBU d’un autre projet, sans modification ni correction critique. Les SBU ont un impact sur l’ensemble de la procédure de qualification et rogner sur la qualité est inutile. Quelques conseils de SBU :
• Supprimer les exigences générales qui ne sont pas applicables. Ces exigences susciteront des discussions inutiles ou même étendront les qualifications.
• N’oubliez pas d’ajouter les données importantes. Consultez vos experts en production afin que les exigences couvrent les besoins réels du processus, comme les débits, la qualité de fonctionnement, l’efficacité, la génération de déchets, les paramètres de la machine, l’assemblage des pièces, les temps d’arrêt, le nettoyage, l’étalonnage, la maintenance, les compétences requises pour utiliser la machine, etc.
Une fois les SBU convenues et approuvées, elles sont généralement partagées avec plusieurs fournisseurs potentiels. Chaque fournisseur répond aux SBU avec un devis et un ensemble de documents de Spécification fonctionnelle (SF), difficiles à lire et souvent impossibles à relier à chaque point des SBU.
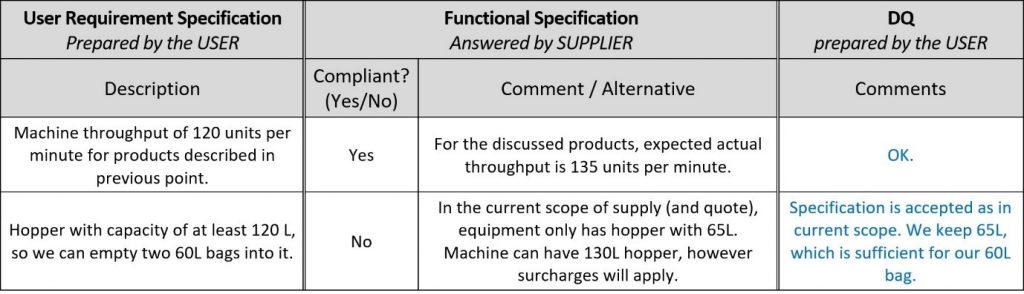
Pour une évaluation plus rapide des offres des fournisseurs, réservez de la place dans le document des SBU pour leurs commentaires et nommez la nouvelle colonne Spécification fonctionnelle, car en fait, les commentaires sont des confirmations et des descriptions fonctionnelles de leur machine ! De cette façon, vous pouvez complètement éviter de lire les documents de conception des fournisseurs. Voici un exemple :
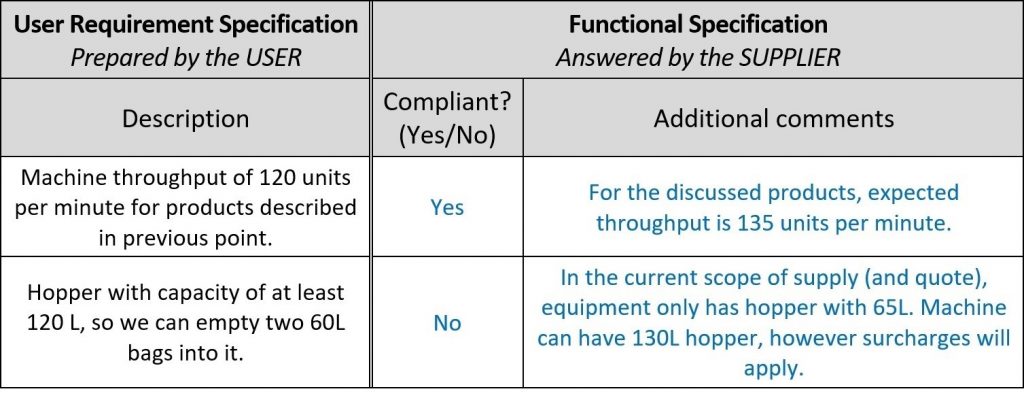
Une fois que les fournisseurs ont fourni leurs commentaires, il est temps de procéder à la Qualification de conception (QC). Comme mentionné en introduction, l’étendue des qualifications dépend de la complexité du système. Dans cet exemple, la QC comporte trois étapes : évaluations des propositions, analyse des risques et mise en place des tests, ce qui semble problématique avec une énorme quantité de travail, mais cela est gérable avec une configuration appropriée.
Dans la première étape de la QC, l’utilisateur doit vérifier si le fournisseur répond aux exigences décrites dans les SBU. Bien sûr, si un fournisseur ne peut pas répondre à toutes les exigences, parlez-lui et trouvez des solutions acceptables pour les deux ou choisissez un fournisseur/une solution plus approprié. Si vous avez ajouté des SBU à la SF, comme proposé dans cet article, une grande partie de la QC peut être effectuée en commentant les commentaires du fournisseur.
Effectuez simplement la QC dans le document SBU/SF en justifiant vos décisions comme dans l’exemple ci-dessous.
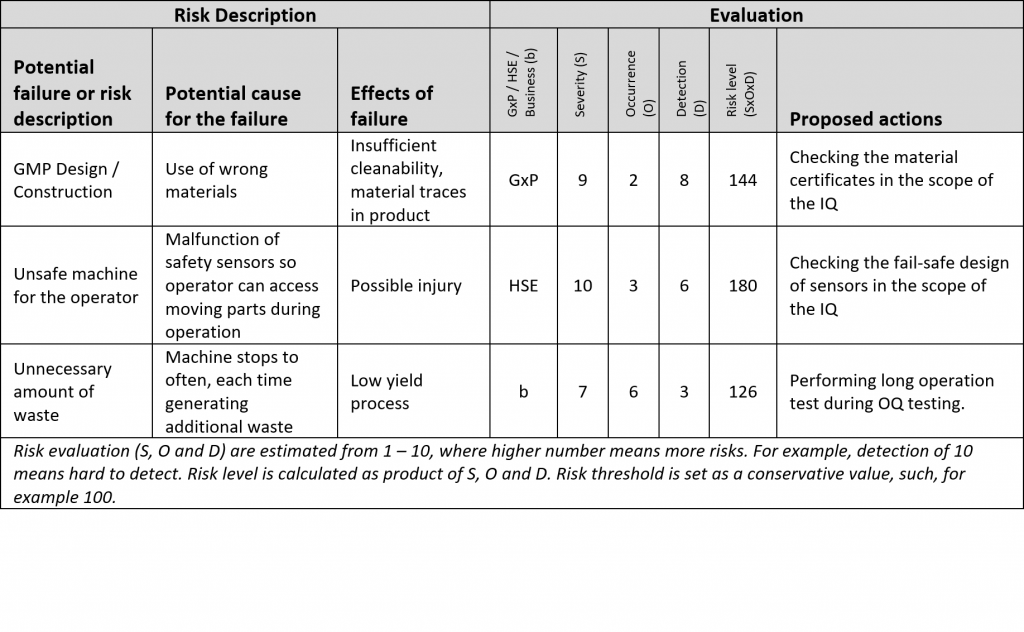
La deuxième étape de la QC est l’analyse des risques. Elle ne démarre qu’une fois la première étape convenue entre l’utilisateur et le fournisseur. L’analyse des risques se traduit en points et spécifications qui doivent être testés et traités lors des qualifications.
L’analyse des risques est une tâche difficile, surtout si la technologie est nouvelle pour l’utilisateur. N’essayez pas de fabriquer un risque possible pour chaque point des SBU. Utilisez l’expérience et le bon sens. Si les risques sont trop difficiles à définir pour une raison quelconque, le fournisseur devrait être en mesure de vous aider. Le fournisseur connaît la solution en profondeur mieux que quiconque.
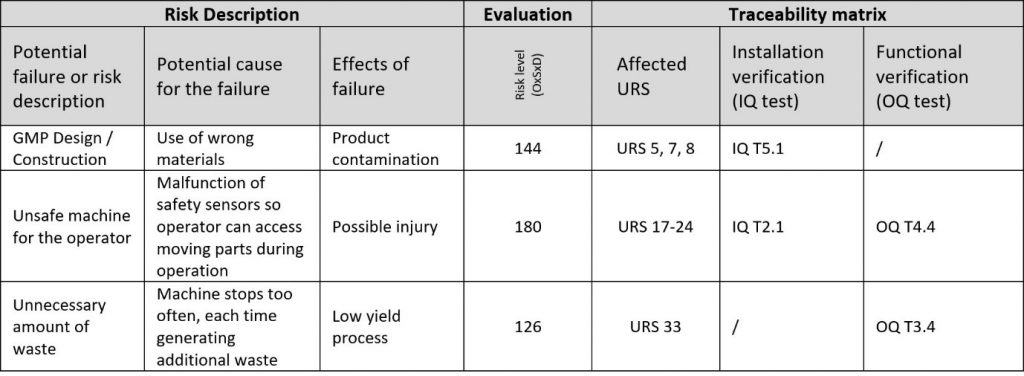
La dernière étape de la QC consiste à mettre en place des tests de qualification pour la phase de vérification du modèle en V. Les tests sont conçus pour vérifier si le fournisseur fournit réellement tout comme convenu. Ils doivent traiter tout risque dépassant le seuil.
Le document QI/QO du fournisseur comprendra des tests pour la plupart des points et risques requis. Jetez un œil à ces tests avant de commencer à configurer de nouveaux tests. Essayez également de justifier les exigences générales et les risques avec des fonctionnalités permettant de simplifier vos protocoles de qualification et de minimiser les tests redondants :
• Prenons un risque en exemple : « Une caméra dans le système d’inspection ne fonctionne pas. ». Ne faites pas de test spécial pour vérifier si la caméra est installée, branchée et fonctionne correctement. Attribuez le risque à un test général, tel que le « démarrage de la machine », que vous ferez de toute façon et justifiez que vous pourrez voir des images en direct sur l’IHM après le démarrage et que, par conséquent, le système dispose d’une caméra fonctionnelle.
• Supposons maintenant un besoin de l’utilisateur en matière de piste d’audit : « Toutes les actions sur la machine doivent être enregistrées sur une piste d’audit. ». Ne faites pas de test spécial « vérifier la piste d’audit ». Essayez d’attribuer le besoin à n’importe quel test opérationnel, où le rapport de lot avec piste d’audit sera vérifié pour une toute autre raison.
Le résultat final de la QC est la matrice de traçabilité, qui relie les risques et les besoins aux tests.
Les matrices de traçabilité sont connues pour beaucoup de choses. Faire gagner du temps à l’équipe de projet n’en fait pas partie. Le défi est de relier les SBU, les risques et les tests de la façon la plus claire et la plus simple possible. Par expérience, il y aura toujours plus de points des SBU que de risques. Pour cette raison, attribuez des points des SBU aux risques et non l’inverse. Certains points des SBU peuvent même ne pas être attribués, ce qui indiquera uniquement que les points SBU non attribués ne présentent aucun risque pour le projet.
Phase de vérification : Enfin, QI, QO, QP
Lorsque la phase de spécifications est terminée et que le fournisseur est prêt pour l’installation, la phase de vérification commence. L’utilisateur et le fournisseur suivront les protocoles QI/QO et l’utilisateur conclura ses qualifications avec QP.
L’utilisateur et le fournisseur doivent se mettre d’accord sur le protocole exact et la portée des tests lors de la QC afin de minimiser la création de nouveaux tests pendant la qualification, ce qui est risqué pour les deux parties.
La QI/QO est généralement effectuée deux fois. Tout d’abord, elle est effectuée chez le fournisseur dans le cadre des tests d’acceptation usine (FAT). Pendant les FAT, toute modification apportée au système en raison de changements d’exigences (cela arrive souvent) ou en raison d’écarts possibles, n’est pas aussi coûteuse que plus tard, lorsque le système se trouve en dehors des installations de fabrication.
Les FAT constituent généralement la première expérience de l’utilisateur avec la machine. Passez autant de temps que possible sur la QO, car elle consiste en des tests au cours desquels la machine effectue son travail. Il est difficile d’imaginer un écart plus important en termes de sécurité ou de fonctionnalité. Cependant, la QI est toujours une condition préalable à la QO, il est donc important d‘effectuer cette validation le plus rapidement possible en ne faisant que le nécessaire et en ignorant des tests plus administratifs avec « N/A au FAT » ou « Pas de risque, à tester au SAT » pour aboutir à la QO le plus rapidement possible.
Deuxièmement, la QI/QO est répétée avec les mêmes produits après l’installation finale sur le site de l’utilisateur dans le cadre des tests d’acceptation du site (SAT).
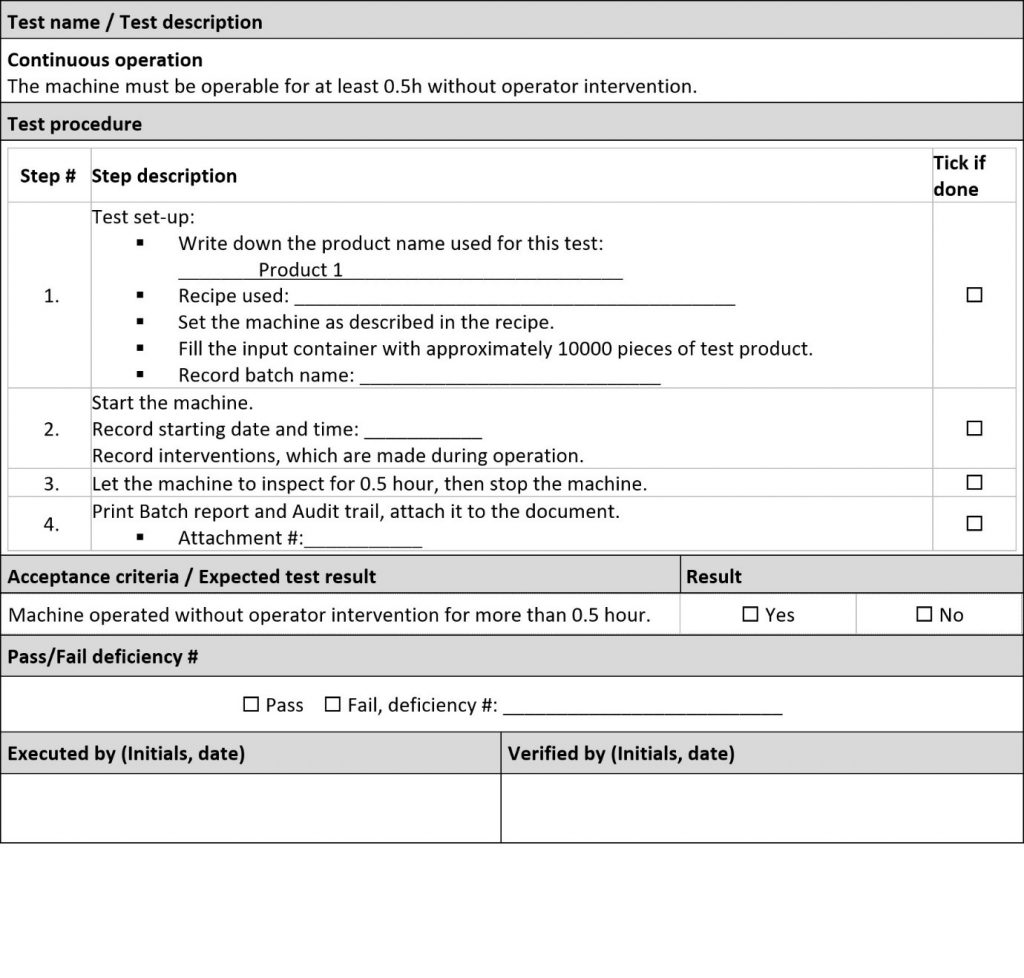
Envoyez l’utilisateur final (opérateurs de la production) vers FAT/SAT. Si les opérateurs effectuent les tests, FAT et SAT constitueront, en même temps, une formation très efficace. De plus, essayez de faire en sorte que les tests opérationnels à partir de la QO ressemblent à de véritables opérations/processus. Les chapitres types inclus dans la QO sont les suivants :
• Configuration matérielle et logicielle avant de démarrer un lot
• Tests d’alimentation/décharge
• Tests de fonctionnement à long terme, évaluation des performances, évaluation de la production de déchets, contrôles du débit
• Tests du temps d’arrêt : Tests de nettoyage, tests de montage/démontage
Les expériences de QO seront les bienvenues lors de la préparation de la QP.
La Qualification des performances (QP) est effectuée par l’utilisateur après un SAT réussi. L’utilisateur doit avoir préparé une procédure opérationnelle standard (SOP) et la suivre pendant la QP. Les produits fabriqués/transformés après une QP réussie peuvent déjà être commercialisés.
Le fournisseur peut vous aider à optimiser votre SOP, qui sera utilisée pendant de nombreuses années. L’optimisation et la modification à ce stade précoce amélioreront le taux de réussite de la QP et celui de toutes les exécutions ultérieures.
Annexes
• Exemple – QI QO pour les tests d’acceptation usine
• Exemple – Modèle de matrice d’évaluation des risques et de traçabilité
• Exemple – Spécifications des besoins de l’utilisateur – SBU
Cet article a été initialement publié dans Pharmaceutical Technology :
– https://www.pharmaceutical-technology.com/sponsored/pharmaceutical-qualification-and-validation/