L’acquisto di un’apparecchiatura non dà il permesso di utilizzarla in un ambiente farmaceutico; la qualificazione e la convalida restano comunque un ostacolo. L’obiettivo principale non è quello di impedire l’utilizzo dell’l’apparecchiatura o di aumentarne i costi, ma di aiutare a garantire una qualità costante dei prodotti finali.
Sensum interagisce con molti team di assicurazione qualità del settore farmaceutico sul tema della qualificazione e della convalida, poiché sviluppa e fornisce soluzioni per l’ispezione visiva automatica dei prodotti finali, che necessitano di una supervisione più stretta da parte dell’assicurazione qualità rispetto ai sistemi di controllo qualità. Per oltre 15 anni, abbiamo sperimentato diversi scenari di qualificazione, che hanno permesso di identificare diverse buone pratiche. Nei paragrafi che seguono è possibile trovare una visione pratica del processo di qualificazione con alcuni consigli utili che potranno aiutare in qualsiasi progetto di qualificazione.
Prima di tutto; cos’è la convalida? E cos’è la qualificazione?
La convalida è un concetto più ampio rispetto alla qualificazione ed è legato a processi come quello della produzione. Può essere spiegato semplicemente come un approccio sistematico che controlla e aiuta i processi ad avere risultati attesi e coerenti. La convalida non coinvolge solo le apparecchiature, ma anche vari sistemi supplementari, software e persone che fanno parte del processo.
La convalida si articola in diverse attività e una di queste è la qualificazione, che è legata all’introduzione di sistemi nel processo. Il compito della qualificazione è quello di assicurare che uno specifico sistema soddisfi i requisiti normativi, gli standard di settore e le prestazioni previsti.
The (in)famous V-model
TIl grado di qualificazione dipende dalla complessità dell’apparecchiatura. Ad esempio, la qualificazione di un contenitore intermedio dovrebbe richiedere minore sforzo rispetto a un sistema di ispezione visiva. Vediamo la qualificazione di un sistema computerizzato configurato, che prevede tutte le fasi tipiche della qualificazione. La procedura di qualificazione ad esempio è presentata nel modello V di seguito con due fasi: specifica e verifica.
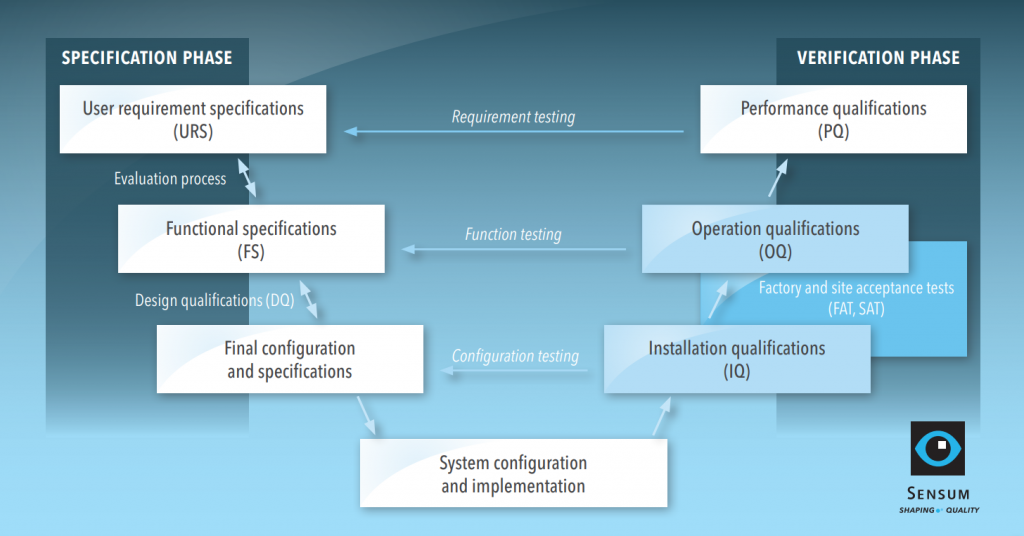
Fase di specifica: da URS a DQ
Le specifiche dei requisiti utente (URS) sono preparate dall’utente finale che indica le proprie aspettative e i requisiti per il processo. L’URS è un documento di base che semplifica l’intero processo di qualificazione.
Sensum, in qualità di fornitore, si imbatte in molte URS. La maggior parte dei documenti URS contiene molti requisiti con oltre 20 pagine, ma i requisiti effettivi rilevanti per il progetto specifico sono scritti in appena uno o due brevi punti. Questo accade perché le URS sono preparate da un modello o da una URS di un altro progetto senza modifiche e correzioni critiche. L’URS ha un impatto sull’intera procedura di qualificazione e non è utile prendere scorciatoie. Alcuni suggerimenti per l’URS:
• Eliminare i requisiti generali non applicabili. Questi requisiti provocheranno discussioni innecessarie o addirittura estenderanno le qualificazioni.
• Non dimenticare di aggiungere i dati importanti. Consultare i propri esperti di produzione in modo che i requisiti coprano le effettive esigenze del processo, come la produttività, qualità di funzionamento, efficienza, produzione di scarto, impostazioni della macchina, assemblaggio delle parti, tempi di inattività, pulizia, calibrazione, manutenzione, competenze richieste per l’utilizzo della macchina, ecc.
Dopo che le URS sono state concordate e approvate, in genere vengono condivise con diversi fornitori potenziali. Ogni fornitore risponde all’URS con un preventivo e una serie di documenti di Specifiche funzionali (FS), difficili da leggere e spesso impossibili da collegare a ciascun punto dell’URS.
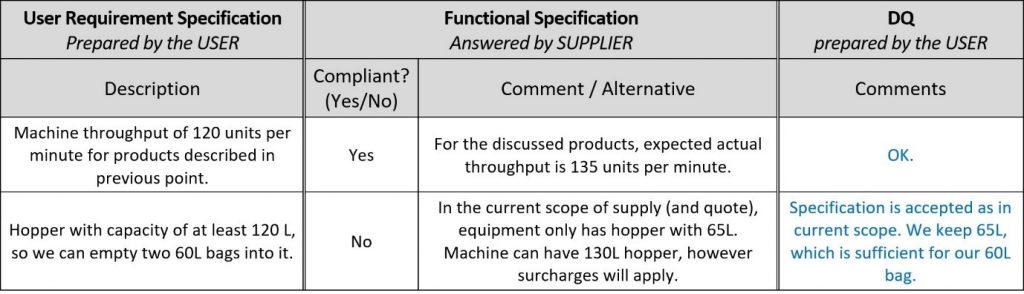
Per una valutazione più rapida delle offerte dei fornitori, lasciare spazio ai loro commenti nel documento dell’URS e chiamare la nuova colonna Specifica funzionale, perché in effetti i relativi commenti sono conferme funzionali e descrizioni della macchina! In questo modo, è possibile evitare del tutto di leggere i documenti di progettazione del fornitore. Ecco un esempio:
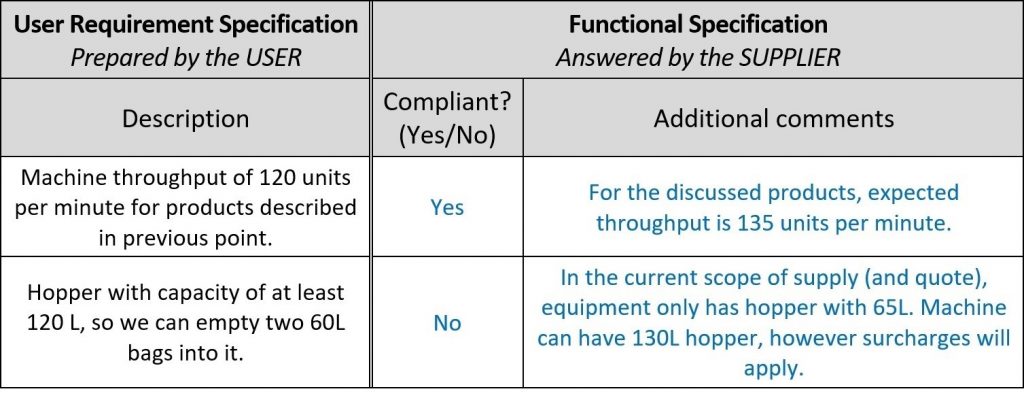
Una volta che i fornitori hanno fornito il loro feedback, è il momento della Qualificazione del progetto (DQ). Come accennato nell’introduzione, la portata delle qualificazioni dipende dalla complessità del sistema. In questo esempio, la DQ prevede tre fasi: valutazioni delle proposte, analisi dei rischi e impostazione dei test, il che sembra problematico con un’enorme mole di lavoro, ma con un’impostazione adeguata è gestibile.
Nella prima fase della DQ, l’utente deve controllare se il fornitore soddisfa i requisiti descritti nell’URS. Inutile dire che se un fornitore non è in grado di soddisfare tutti i requisiti, occorre parlarne con lui e trovare soluzioni accettabili per entrambi o scegliere un fornitore/soluzione più appropriati. Se si aggiunge l’URS alle FS, come proposto in questo articolo, gran parte della DQ può essere eseguita rispondendo ai commenti del fornitore.
È sufficiente eseguire la DQ nel documento URS/FS, giustificando le proprie decisioni come nell’esempio seguente.
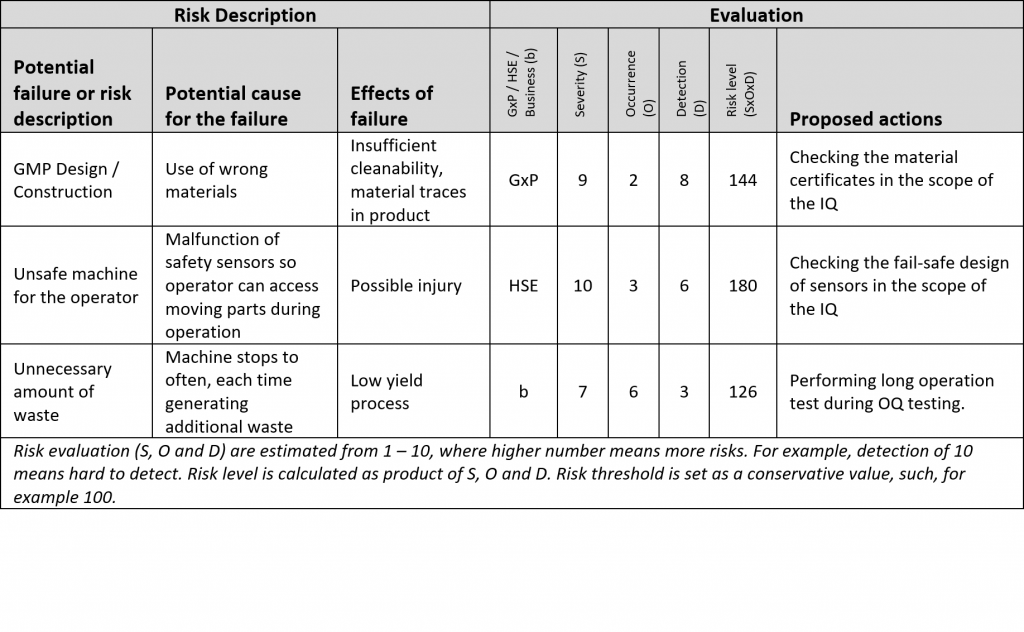
La seconda fase della DQ è l’analisi dei rischi e viene iniziata solo dopo che la prima fase è stata concordata tra l’utente e il fornitore. Il risultato dell’analisi dei rischi sono punti e specifiche che devono essere testati e affrontati durante le qualificazioni.
L’analisi dei rischi è un compito difficile, soprattutto se la tecnologia è nuova per l’utente. Non tentare di creare un possibile rischio per ogni punto delle URS. Usare l’esperienza e il buon senso. Se per qualche motivo i rischi sono troppo difficili da definire, il fornitore dovrebbe essere in grado di aiutare con l’analisi dei rischi. Il fornitore conosce la soluzione in dettaglio meglio di chiunque altro.
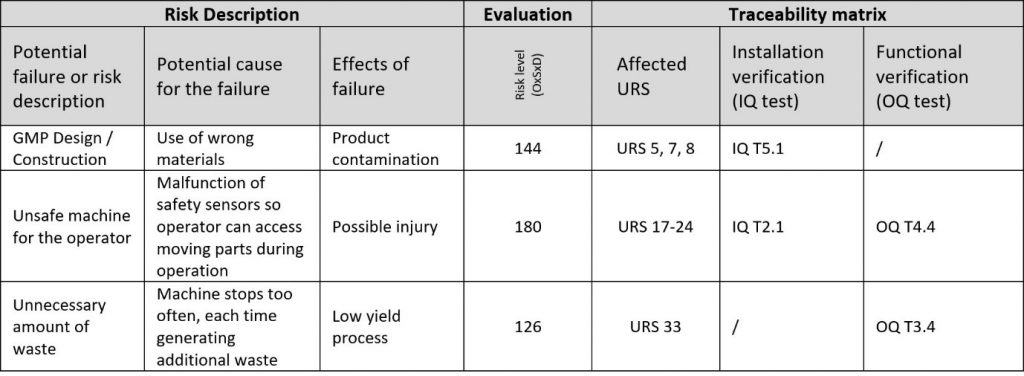
L’ultima fase della DQ consiste nel predisporre i test di qualificazione per la fase di verifica del modello V. I test devono controllare se il fornitore fornisce davvero tutto ciò che è stato concordato e dovrebbe occuparsi di qualsiasi rischio che sia stato superiore alla soglia di rischio.
Il documento IQ/OQ del fornitore includerà test per la maggior parte dei punti e rischi richiesti. Dare un’occhiata a questi test prima di iniziare a impostarne di nuovi. Inoltre, cercare di giustificare i requisiti generali e i rischi con la funzionalità per semplificare i protocolli di qualificazione e ridurre al minimo i test ridondanti:
• Ipotizziamo un rischio: ”Una telecamera del sistema di ispezione non funziona”. Non effettuare un particolare test per verificare se la telecamera è installata, collegata all’alimentazione e funzionante. Assegnare il rischio a un test generale, come ”l’avvio della macchina”, che sarà comunque effettuato, e giustificare il fatto che dopo l’avvio sarebbe possibile vedere immagini in diretta sull’HMI, pertanto, il sistema ha una telecamera funzionante.
• Supponiamo adesso un requisito di audit trail dell’utente: “Tutte le azioni sulla macchina devono essere registrate nell’audit trail”. Non effettuare un particolare test per ”controllare l’audit trail”. Tentare di assegnare il requisito a qualsiasi test operativo, in cui il rapporto lotto con audit trail sarà controllato per qualsiasi altro motivo.
Il risultato finale della DQ è la matrice di tracciabilità, che collega i rischi e i requisiti con i test.
Le matrici di tracciabilità sono note per molte cose. Risparmiare il tempo del team di progetto non è una di queste. La sfida consiste nel rendere chiari e più semplici possibili i collegamenti tra URS, rischi e test. Per esperienza, vi saranno sempre più punti delle URS che rischi in numero. Per questo motivo, assegnare i punti delle URS ai rischi e non viceversa. Alcuni punti delle URS potrebbero anche non essere assegnati, il che indicherà solo che i punti non assegnati delle URS non sono rischiosi per il progetto.
Fase di verifica: Infine: QI, OQ e PQ
Quando la fase delle specifiche è terminata e il fornitore è pronto per l’installazione, inizia la fase di verifica. L’utente e il fornitore seguiranno i protocolli IQ/OQ e l’utente concluderà le qualifiche con PQ.
L’utente e il fornitore dovrebbero concordare il protocollo esatto e l’ambito dei test durante la DQ per ridurre al minimo la creazione di nuovi test durante la qualificazione, che è rischiosa per entrambe le parti.
IQ/OQ vengono in genere effettuate due volte. In primo luogo, viene effettuata presso il fornitore come parte dei test di accettazione in fabbrica (FAT). Durante i FAT, eventuali modifiche al sistema dovute a cambiamenti dei requisiti (che si verificano spesso) o a possibili variazioni non sono così costose come in seguito, quando il sistema è fuori dalle strutture di produzione.
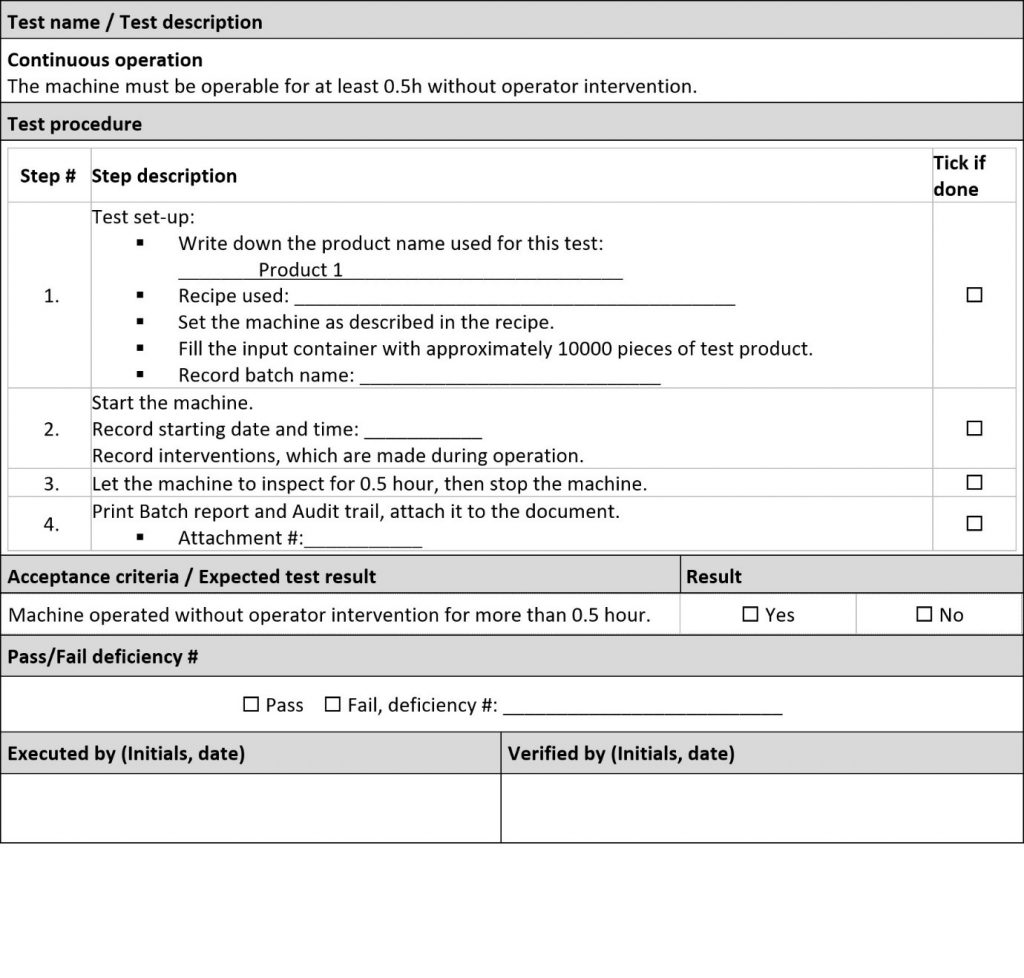
FAT è di solito la prima esperienza dell’utente con la macchina. Dedicare più tempo possibile all’OQ, perché è costituita da test in cui la macchina svolge il suo lavoro. È difficile immaginare una variazione peggiore come una variazione di sicurezza o funzionale. Tuttavia, l’IQ è ancora un prerequisito per l’OQ, quindi tentare di farlo il più velocemente possibile facendo solo le cose necessarie e saltando i test più amministrativi con ”N/D in FAT” o “Non rischioso, da testare in SAT” per arrivare all’OQ il più velocemente possibile.
In secondo luogo, l’IQ/OQ viene ripetuto con gli stessi prodotti dopo l’installazione finale presso il sito dell’utente come parte dei test di accettazione del sito (SAT).
Inviare l’utente finale (operatori della produzione) a FAT/SAT. Se gli operatori eseguono i test, FAT e SAT diventano contemporaneamente una formazione molto efficiente. Inoltre, cercare di far sembrare i test operativi dell’OQ come operazioni/processi reali. I tipici paragrafi inclusi nell’OQ sono:
• Configurazione dell’hardware e del software prima di iniziare un lotto
• Test di alimentazione/scarico
• Test per il funzionamento a lungo termine, valutazione delle prestazioni, valutazione della produzione di rifiuti, controlli di produttività.
• Test dei tempi di inattività: Test di pulizia, test di assemblaggio/smontaggio
Le esperienze di OQ saranno molto apprezzate per la preparazione della PQ.
La qualificazione delle prestazioni (PQ) viene eseguita dall’utente dopo l’esito positivo dei SAT. L’utente dovrebbe aver preparato una procedura operativa standard (SOP) e seguirla durante la PQ. I prodotti realizzati/lavorati dopo il successo della PQ possono essere già utilizzati a livello commerciale.
Il fornitore può aiutare a ottimizzare la SOP, che verrà utilizzata per molti anni. L’ottimizzazione e la modifica in questo punto iniziale miglioreranno il tasso di successo della PQ e di tutte le esecuzioni successive.
Allegati
• Esempio – IQ OQ per i test di accettazione in fabbrica
• Esempio – Modello di matrice di valutazione dei rischi e tracciabilità
• Esempio – Specifiche dei requisiti utente – URS
Questo articolo è stato pubblicato originariamente su Pharmaceutical Technology:
– https://www.pharmaceutical-technology.com/sponsored/pharmaceutical-qualification-and-validation/